Fiziologie celulară și moleculară Fiziologie generală Fiziologie oro-maxilo-facială
Fiziologie celulară și moleculară
Pompa de Na+/K+
Deși transportul activ transmembranar era cunoscut de aproape 30 de ani și totodată se presupunea existența unei structuri proteice membranare responsabile pentru efectuarea sa, pompa de Na+/K+ (sau Na+/K+ ATP-aza) a fost identificată pentru prima dată în anii ’50 în neuroni de Jens Christian Skou, chimist danez, descoperire pentru care primește premiul Nobel pentru chimie în anul 1997 alături de Paul D Boyer și John E. Walker. Totodată ea a fost prima structură proteică membranară descoperită care funcționa pentru stabilirea gradientelor ionice prin efectuarea unui transport de tip vectorial, orientat.
Aspecte de fiziologie moleculară referitoare la pompa de Na+/K+:
- fluxurile de Na+ și de K+ sunt operațional inseparabile (de ex. îndepărtarea K+ extracelular reduce dramatic efluxul de Na+ și invers)
- pompa transportă în mod alternativ ionii de Na+ și de K+ prin membrană într-un proces ciclic alimentat energetic de transferul unei grupări fosfat din molecula de ATP către pompă
- utilizează între 20% – 40% din consumul energetic total al creierului
- pompa de Na+/K+ posedă caracteristici de structură și secvență primară care permit doar ionilor de Na+ și de K+ să se lege de aceasta și să fie transportați prin membrană
- pentru fiecare moleculă de ATP scindată pompa transferă 3 ioni de Na+ din citoplasmă către mediul extracelular și 2 ioni de K+ în sens invers. Această stoichiometrie a transportului determină pierderea unei sarcini pozitive din mediul intracelular pe fiecare ciclu de funcționare al pompei, ceea ce polarizează membrana. Astfel, pompa este electrogenă și asimetrică.
- funcționarea pompelor ionice (ATP-aze de tip P) este mult mai lentă decât difuzia prin canalele ionice, ceea ce face ca intensitatea curentului Na+/K+ ATP-azic să fie mult mai mică decât cea mediată de canalele ionice (mai puțin de 1% față de canalele de Na+ voltaj dependente). Prin caracterul electrogen, activitatea pompelor de Na+/K+ participă la potențialul membranar de repaus cu mai puțin de 1 mV.
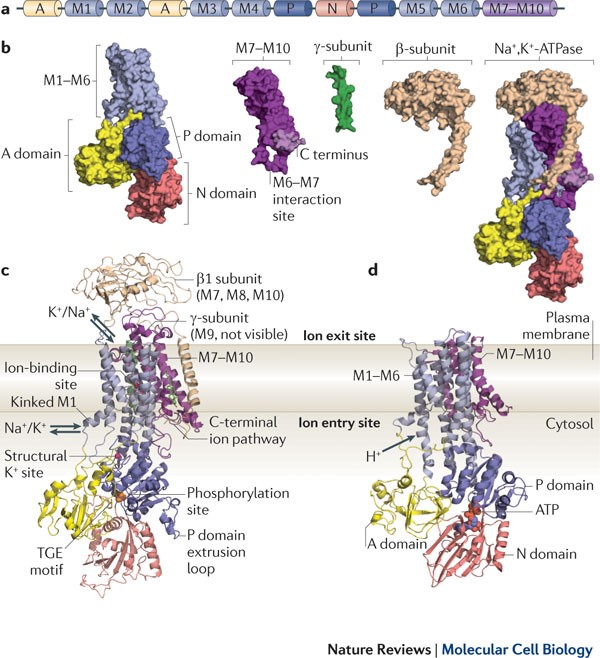
Structura Na+/K+ ATP-azei:
- pompa de Na+/K+ este o proteină integrală alcătuită din 3 subunități: α, β, γ
- Subunitatea α. Are în componența sa 10 α-helix-uri transmembranare și un domeniu intra-citoplasmatic. Conține în porțiunea citoplasmatică trei sub-domenii numite: A (actuator), N (nucleotide-binding) și P (phosphorilation) care prezintă un înalt grad de conservare în familia ATP-aze-lor
- conține aproximativ 1000 de aminoacizi
- ATP-ul este legat de domeniul N iar enzima fosforilează de domeniul P.
- Actuatorul (elementul de acționare) cuplează această reacție cu manipularea segmentelor transmembranare pentru închiderea sau deschiderea situsurilor de cuplare pentru Na+ sau K+
- Subunitatea α este răspunzătoare pentru aproape întreaga activitate de pompare a Na+/K+ ATP-azei. Structura minimală pentru îndeplinirea funcției conține domeniile A, N, P și M1-M6 (alfa –helixurile M1-M6)
- Subunitatea β (aproximativ 300 AA) are 2 roluri: ghidajul pompei pentru inserarea în membrană și „ascunderea” ionilor de K+ față de expunerea acestora către ambele suprafețe ale membranei în timpul modificărilor conformaționale de transfer.
- Subunitatea β conține un singur domeniu transmembranar
- Porțiunea principală a domeniului β se regăsește pe fața extracelulară
Ciclul de pompaj:
- Pompa cuplează o moleculă de ATP și 3 ioni de Na+ din citoplasmă
- ATP-ul fosforilează pompa care suferă o modificare conformațională creând o deschidere către mediul extracelular
- Ionii de Na+ sunt eliberați și în locul lor sunt captați 2 ioni de K+
- Gruparea fosfat este clivată de pe situl de fosforilare și pompa revine la conformația inițială eliberând ionii de K+ în citoplasmă
- Ciclul se reia → 1.
- în starea 1. pompa are afinitate crescută pentru Na+
- în starea 3. afinitatea este crescută pentru K+ (gruparea fosfat este încă legată la situl de cuplare al ATP)
Fiziologie oro-maxilo-facială
Reglarea reflex necondiţionată a secreţiei salivare
Reglarea (adaptarea) secreţiei salivare se realizează predominant pe cale nervoasă şi secundar pe cale umorală, această ultimă cale fiind mai mult una de modulare.
Arcul reflex salivator este format din următoarele segmente structurale anatomo-funcționale:
- receptorii şi ariile receptoare;
- căile aferente;
- centri nervoşi salivatori inferiori-parasimpatici (din trunchiul cerebral) şi simpatici (din măduva toracală T1-T3);
- căile eferente (secreto-motorii);
- efectorii (glandele salivare)
1. Receptorii şi ariile receptoare
Populațiile de receptori implicați în stimularea secreției salivare fac parte, în ordinea gradului de participare, din următoarele clase de receptori:
- mecanoreceptorii faciali cutanați (stimulați de atingere) dar îndeosebi cei orali activați de iritaţia, atingerea şi presiunile aplicate mucoasei orale și linguale în cursul ingestiei de lichide sau masticaţiei de alimente solide, a deglutiţiei bolului alimentar, a contactului cu aparate dentare protetice sau ortodontice sau după apariţia unor dinţi noi -stimulează secreția salivară. Aplicarea aparatelor ortodontice determină numai temporar creșterea secreţiei salivare, dar pot alarma pacientul la începutul acestui tip de terapie;
- receptori senzoriali gustativi (linguali, orali, faringieni superiori);
- algoreceptori (nociceptori) sensibili la stimuli dureroși digestivi (stimuli având ca arii de plecare zone din stomac, intestin, apendice, vezica biliară în condițiile unor disfuncționalități date de procese iritative, inflamatorii, tumorale) și extradigestivi ;
- proprioceptori din tendoane şi muşchi masticatori, generatori de impulsuri cu efect secretor în cursul secreţiei salivare de masticaţie ; stimularea proprioceptivă unilaterală a ligamentului periodontal, a muşchilor masticatori şi a articulaţiilor temporo-mandibulare conduce predominant la creşterea ipsilaterală a secreţiei salivare;
- interoceptori (receptori de întindere–distensie) prezenţi în peretele faringelui, esofagului şi stomacului care sunt stimulaţi la trecerea bolului alimentar în cursul deglutiţiei (reflexul esofago-salivar, reflexul gastro-salivar); este cazul îndeosebi a carcinomului esofagian asociat de regulă cu o puternică salivaţie şi o deglutiţie dureroasă severă;
- receptori senzoriali olfactivi.
2. Căile aferente: în principal sunt căi senzorial-senzitive reprezentate de terminaţiile şi în continuare de fibrele ramurilor nervilor cranieni facial (n.VII), gloso-faringian (n.IX), vag (n.X) şi trigemen (n.V).
Ramurile senzoriale şi senzitive plecate de la receptorii oro-faringieni sunt reprezentate de:
- fibre senzoriale ale nervului facial ce se adună în ramul coarda timpanului al inervaţiei gustative; ele sunt dendrite ale neuronilor de ordinul I din ganglionul geniculat al facialului preluând informaţii de la mugurii gustativi prezenţi în 2/3 anterioare ale limbii. Fibrele senzoriale gustative ale corzii timpanului se alătură în continuare fibrelor nervului lingual (ram senzitiv al nervului mandibular trigeminal) cu care se întâlneşte. Ajunse la ganglionul geniculat al facialului, impulsurile senzoriale gustative se propagă mai departe prin axonii neuronilor geniculaţi înmănunchiate sub numele de nervul intermediar al lui Wrisberg (nervul VII-bis). Axonii neuronilor geniculaţi de ordinul I continuă segmentul de conducere al analizatorului gustativ ajungând în partea superioară a nucleului tractului solitar (NTS) reprezentată de subnucleul gustativ lui Nageotte ce conţine neuronii de ordinul II ai căii gustative. O parte din axonii neuronilor din subnucleul gustativ al NTS se îndreaptă spre neuronii talamici (unde fac sinapsă cu neuroni de ordinul III), Alți axoni (colaterali) cu origine în subnucleul gustativ Nageotte menționat mai sus, se îndreaptă spre nucleul salivator superior parasimpatic având rol stimulator secreto-salivar asupra acestora.
- fibre senzorial-senzitive ale nervului glosofaringian (nervul IX) ce conduc informaţii gustative de la mugurii gustativi din 1/3 posterioară a limbii și care reprezintă dendrite ale neuronilor din ganglionul Andersch (neuroni de ordinul I). De la acesta, fibre axonale continuă calea gustativă proiectând în neuronii tractului solitar (subnucleul gustativ al lui Nageotte), iar de aici o parte din axoni continuă calea talamo-corticală a sensibilității gustative, în timp ce alt grup de axoni (axoni colaterali) ajung în neuronii nucleului salivator inferior din bulb purtând mesaje gustative stimulatorii secreto-salivare.
- fibre din ramurile linguală, bucală şi palatină ale trigemenului (nervii senzitivi maxilar şi mandibular) reprezentând dendrite ale neuronilor din ganglionul Gasser (neuroni de ordinul I al căilor senzitive trigeminale) transmit informaţii mecano-senzitive de atingere şi presiune (linguale, gingivale, dentare, palatinale, faciale), semnale privind modificări de temperatură sau semnale nociceptiv-dureroase la neuronii subnucleului caudalis, componentă a nucleului spinal senzitiv al trigemenului (neuroni de ordinul II). În continuare informațiile ajung atât la neuronii nucleilor salivatori bulbo-pontini prin colaterale cu efect stimulator (iar de aici la glandele salivare), cât şi la cei din marea stație senzitivă reprezentată de complexul ventro–bazal talamic (neuroni talamici de integrare de ordinul III de pe calea Sistemului senzitiv trigeminal).
3. Centrii nervoşi secreto-motori ai reglării reflexe a secreţiei salivare
Centrii nervoşi reflecşi salivari parasimpatici au sediul în substanţa reticulată bulbo-pontină. Ei conţin neuroni efectori secreto-motori fiind constituiţi anatomo-topografic din o fâşie continuă de neuroni, funcţional este însă acceptată diferenţierea şi „delimitarea” unor structuri parasimpatice nucleare şi anume nucleul salivator superior (pontin) şi nucleul salivator inferior (bulbar).
Centrii nervoşi reflecşi salivari simpatici sunt reprezentaţi de neuroni simpatici preganglionari prezenţi în primele două segmente toracale (T1-T2) ale măduvii spinării în hemisegmentul anterior al coarnelor laterale şi care, prin prelungirile lor axonice fac sinapsă cu neuronii ganglionului cervical superior de unde pleacă fibre post-ganglionare adrenergice secreto-motorii la glandele salivare.
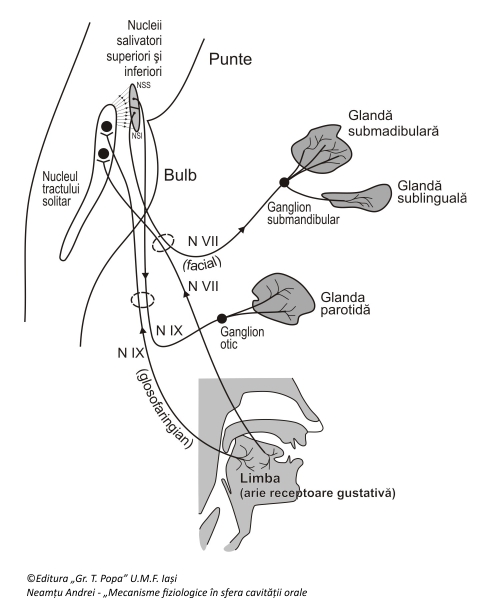 Sistemul secreto-motor salivar colinergic.
Sistemul secreto-motor salivar colinergic.
4. Căile eferente
Distribuţia fibrelor vegetative parasimpatice şi simpatice se realizează pe căi distincte pentru glandele parotide, submaxilare, sublinguale şi glandele parietale orale.
- Sistemul secreto-motor colinergic (parasimpatic) eferent ce asigură activitatea secretorie a glandei parotide este reprezentat de neuronii parasimpatici din nucleul salivator inferior (NSI), fibrele parasimpatice (colinergice) preganglionare care au originea în NSI din bulb, neuronii ganglionului otic și fibrele post-ganglionare ale acestuia care se termină în gland parotidă. Inervaţia parasimpatică a glandelor sublinguale şi submandibulare îşi are originea în nucleul salivator superior din punte, fibrele emergente preganglionare din acesta împrumutând apoi calea nervului intermediar al lui Wrisberg (n.VII-bis) trecând (fără a face sinapsă) prin ganglionul geniculat al facialului; după ce părăsesc acest ganglion coboară prin nervul coarda timpanului şi apoi pe calea nervului lingual (ramură a trigemenului -n. V) de care se desprinde în planşeul bucal. Fibrele ajung în ganglionii submaxilari şi sublinguali (ganglionii Langley) unde fac sinapsă, iar fibre post-ganglionare foarte scurte pătrund apoi în glandele submaxilare şi sublinguale.
- Sistemul secreto-motor adrenergic eferent: este comun tuturor glandelor salivare, fibrele simpatice (adrenergice) având neuronii de origine în măduva spinării –segmentul toracal, la nivelul segmentelor T1–T2 din jumătatea anterioară (motorii) a coarnelor medulare laterale. Fibrele preganglionare părăsesc măduva pe calea rădăcinilor anterioare ale nervului rahidian I de care se desprind şi se alătură ramurilor comunicante albe îndreptându-se spre lanţul ganglionar simpatic latero-vertebral unde fac sinapsa cu neuronii din ganglionul cervical superior. Fibrele post-ganglionare se ataşează în continuare ramurilor comunicante cenuşii de care se despart pătrunzând odată cu arterele în glandele parotide submaxilare şi sublinguale (calea plexurilor perivasculare).
5. Efectorii – glandele salivare principale (parotide, sublinguale și submaxilare) și secundare (von Ebner)
Efectele reflexului de axon în pulpa dentară
Nervii senzitivi alveolari pot prezenta reflexul de axon, reflex în care circulația influxului nervos de la periferie spre neuronul senzitiv, odată ajunsă pe parcursul său la acesta sau chiar mai devreme, la prima bifurcație de ramuri nervoase, este deviată devenind antidromică (eferentă) pe unul din ramurile aferente, sensul deplasării influxului nervos fiind acum de la neuronul senzitiv (sau de la bifurcație) spre periferie. Acest reflex nu are de-a lungul căii sale neuroni de integrare sau sinapse. Reflexul de axon este binecunoscut la nivelul pielii, când o excitație cutanată (de exemplu pruritul, excitația nociceptivă sau iritativă) este urmată de grataj determinând triada lui Lewis (vazodilatație cutanată, papula și edem) dar este descris și la glandele sudoripare și în reacțiile alergice cu răspuns mastocitar. Reflexul de axon numit și reflex antidromic sau nocifensiv a fost identificat și la țesutul pulpar.
 În condițiile unor stimulări nociceptive pulpare, potențialele de receptor sunt codificate în potențiale de acțiune care circulă pe o dendrită a nervului alveolar în sens centripet, aferent. În aceste condiții este posibil ca la prima ramificație de ramuri nervoase, potențialele de acțiune senzitive să își schimbe direcția și sensul de circulație, fiind conduse înapoi spre periferie pe o altă dendrită, în sens eferent de această dată, influxurile nervoase finalizându-se pe un organ efector (de exemplu mușchii netezi ai unui vas sanguin din pulpa dentară). Descărcarea de potențiale la capătul acestei dendrite determină modificări vazodilatatorii, creșterea filtrării plasmei prin peretele vascular si instalarea edemului, activarea diviziunii fibroblaștilor, stimularea formării de noi vase sanguine și acțiuni trofice. Fibrele nervoase distribuite intrapulpar având în cea mai mare parte funcții algoconductoare (fibre C) s-au dovedit ca fiind nu numai contributoare la reacții dureroase, ci și la puternice reacții vasculare asociate, reflexul de axon fiind unul din principalele mecanisme de realizare a unor astfel de efecte. Aceste reacții sunt mediate la capătul terminațiilor nervoase de către neurotransmițători ai durerii de tip neuropeptide (cum sunt substanța P sau/și izomerul calcitoninei CGRP) sau de către monoxidul de azot. Reacțiile vazomotorii pulpare se aseamănă cu cele obținute prin stimularea fibrelor nervoase motorii destinate mușchilor netezi vasculari ce au ca răspuns vazodilatația.
În condițiile unor stimulări nociceptive pulpare, potențialele de receptor sunt codificate în potențiale de acțiune care circulă pe o dendrită a nervului alveolar în sens centripet, aferent. În aceste condiții este posibil ca la prima ramificație de ramuri nervoase, potențialele de acțiune senzitive să își schimbe direcția și sensul de circulație, fiind conduse înapoi spre periferie pe o altă dendrită, în sens eferent de această dată, influxurile nervoase finalizându-se pe un organ efector (de exemplu mușchii netezi ai unui vas sanguin din pulpa dentară). Descărcarea de potențiale la capătul acestei dendrite determină modificări vazodilatatorii, creșterea filtrării plasmei prin peretele vascular si instalarea edemului, activarea diviziunii fibroblaștilor, stimularea formării de noi vase sanguine și acțiuni trofice. Fibrele nervoase distribuite intrapulpar având în cea mai mare parte funcții algoconductoare (fibre C) s-au dovedit ca fiind nu numai contributoare la reacții dureroase, ci și la puternice reacții vasculare asociate, reflexul de axon fiind unul din principalele mecanisme de realizare a unor astfel de efecte. Aceste reacții sunt mediate la capătul terminațiilor nervoase de către neurotransmițători ai durerii de tip neuropeptide (cum sunt substanța P sau/și izomerul calcitoninei CGRP) sau de către monoxidul de azot. Reacțiile vazomotorii pulpare se aseamănă cu cele obținute prin stimularea fibrelor nervoase motorii destinate mușchilor netezi vasculari ce au ca răspuns vazodilatația.
Efectele relației presiune-volum în hemodinamica pulpei dentare
Pulpa dentară se află într-o cavitate închisă, inextensibilă, delimitată de pereți rigizi. Dinamica vasculară în această situație are un comportament aparte de răspuns la diverse solicitări și cerințe de adaptare. Principalul parametru fizic care trebuie asigurat permanent în aceste condiții este menținerea unui flux și debit sanguin constant în împrejurări care au tendința de a tulbura homeostazia circulației pulpare. Situația de organ prezent într-o cavitate închisă, aseamnă mult pulpa dentară cu situația în care se află creierul, poziționat de asemenea într-o cavitate cu pereți rigizi reprezentați de oasele cutiei craniene. Cea mai frecventă situație patologică ce privește pulpa dentară din acest punct de vedere este reprezentată de inflamație care poate apare frecvent ca urmare a unui proces cariogen asociat cu infecție sau uneori ca rezultat al diverselor proceduri dentare aplicate. Se știe că simpla preparare a cavității dentare, la fel ca și procesul inflamator, cauzează leziuni ale celulelor țesutului pulpar, ale pereților vaselor de sânge, ale celulelor sanguine și nu în ultimul rând ale terminațiilor fibrelor nervoase pulpare. Aceste circumstanțe induc o creștere semnificativă a concentrațiilor de substanță P, histamină și serotonină, substanțe cu o puternică acțiune vazodilatatorie arteriolară în primul stadiu al inflamației, asociată cu creșterea presiunii sanguine locale în condițile existenței spațiului închis susmenționat.
Compresiunea exterioară pasivă asupra venulelor datorată învelișului rigid al camerei pulpare induce creșterea presiunii venoase și creșterea evacuării sângelui venos, ca mecanism rapid de intervenție ce are ca efect scăderea fluxului venos, a presiunii venoase și implicit a celei arteriolare. Se încearcă în acest mod păstrarea unui raport stabil și constant între volumul, presiunea și debitul sanguin în pulpa dentară extrem de necesar asigurării condițiilor homeostazice ale funcționării acesteia. În alte situații în care apare dimpotrivă, o scădere inițială a fluxului sanguin pulpar datorată prezenței, de exemplu, a unei cantități crescute de histamină cu efect hiperpermiabilizant asupra pereților vasculari, trecerea unei părți a plasmei sanguine prin extravazare determină o creștere a presiunii tisulare asupra vaselor venoase pulpare urmată (ca efect de contracarare) de creșterea evacuării sanguine din aceste vase pentru a asigura un debit constant. În plus, scăderea debitului venos „ab initio” induce activarea receptorilor beta-adrenergici din pereții vaselor arteriale urmată de creșterea debitului sanguin arterial prin vazodilatație, ceea ce poate induce creșterea presiunii sanguine tisulare în cavitatea inchisă a pulpei dentare prin aflux de sânge crescut, urmată din nou de creșterea evacuării venoase. Moleculele plasmatice care au fost extravazate sunt și ele rapid readuse în sistemul microcirculator pulpar, întreg sistemul vascular reacționând și de această dată pentru reinstalarea și menținerea homeostaziei.
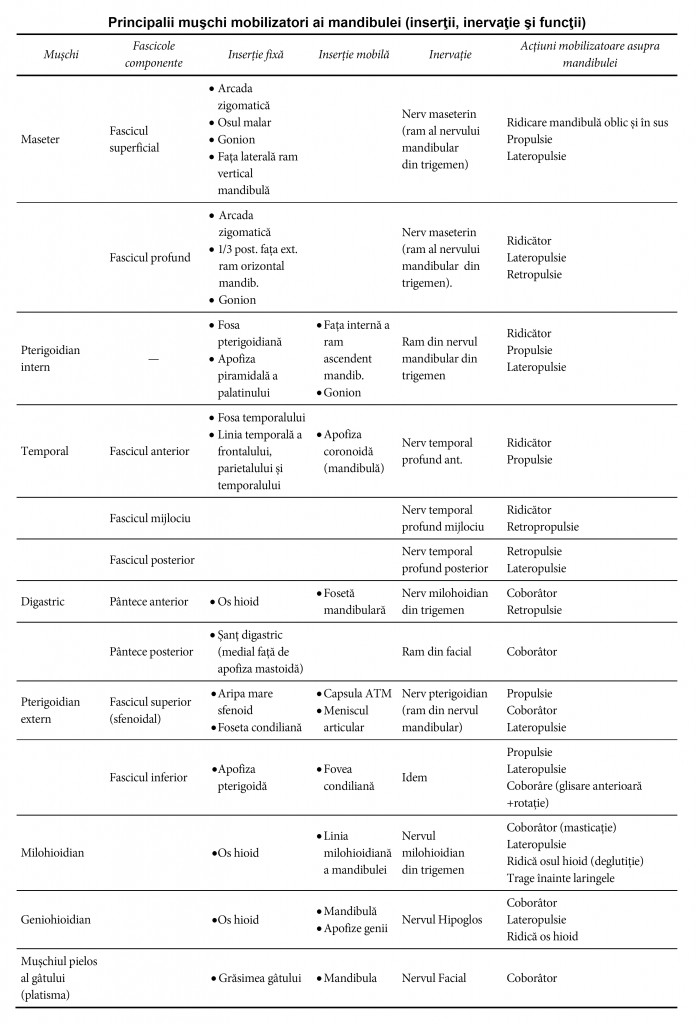
Mușchii mobilizatori ai mandibulei
 6341total visits.
6341total visits.
 6341total visits,1visits today
6341total visits,1visits today